SAKRACY 再生医療等製品 サクラシー
- 製品概要・製品情報
- 効能・効果又は性能
- 製品構成と剤型
- 眼表面疾患の原因となる病気
- 開発の経緯
- 治療スキームと移植後の管理
- 臨床試験成績
製品概要・製品情報
サクラシーは、患者さま自身より採取した口腔粘膜組織から単離した口腔粘膜上皮細胞を、ヒト羊膜から調製した羊膜基質上に播種・培養して製造した培養自己口腔粘膜上皮細胞シートです。
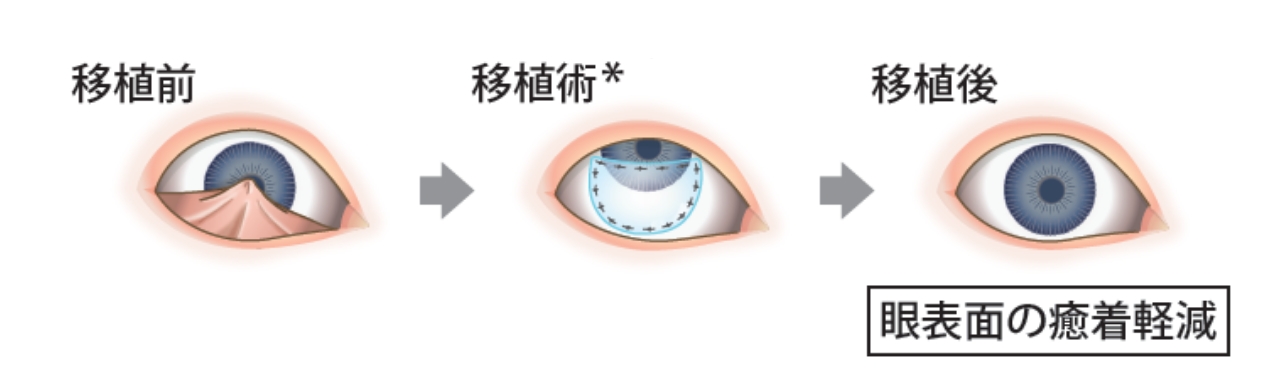
角膜上皮幹細胞疲弊症に伴う瞼球癒着や結膜嚢短縮といった眼表面疾患のある患者さまに対して、癒着の解除や瘢痕組織の除去をした後、露出した角膜や強膜上に移植することで、口腔粘膜上皮細胞が生着・上皮化し、眼表面の異常を修復することを目的としています。
-
商品名製品名:サクラシー
一般名:ヒト羊膜基質使用ヒト(自己)口腔粘膜由来上皮細胞シート
販売名:サクラシー -
製造販売元CynosBio株式会社
-
JANコード口腔粘膜組織輸送セット:4595124264026
培養自己口腔粘膜上皮細胞シートパッケージ:4595124264019 -
承認番号30400FZX00001000
-
承認年月2022年1月
-
保険適用2022年9月
効能・効果又は性能
角膜上皮幹細胞疲弊症における
眼表面の癒着軽減
関連する使用上の注意
-
本品は角膜上皮幹細胞疲弊症の原因を治療するものではないことから、角膜上皮幹細胞疲弊症の原因となる疾患の管理を行った上で本品を使用すること
-
臨床試験に組み入れられた患者の背景(癒着の程度等)について、臨床試験の内容を熟知し、本品の有効性及び安全性を十分に理解したうえで、適応患者の選択を行うこと
製品構成と剤型
口腔粘膜組織輸送セット

培養自己口腔粘膜上皮細胞シートパッケージ
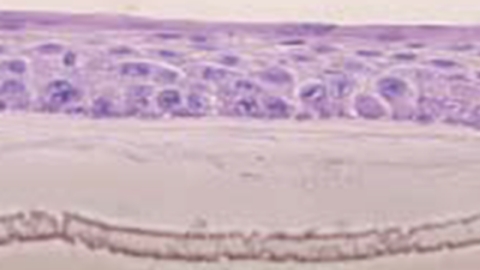
羊膜基質上に重層化された口腔粘膜上皮細胞のHE染色像
Nakamura,T et al. Br J Opthalmol 2004 より引用
製造販売後調査等
サクラシーは全症例を対象に使用成績調査を実施しています(登録期間:2023年2月1日~2029年12月24日)。
使用成績調査で得られた有害事象・不具合一覧を掲載します。
-
再審査期間中使用成績等定期報告
ヒト羊膜基質使用ヒト(自己)口腔粘膜由来上皮細胞シート サクラシー「再審査期間中使用成績等定期報告」有害事象・不具合一覧(1~3年次報告)
01
眼表面疾患の
原因となる病気
02
開発の経緯
03
治療スキームと
移植後の管理
04
臨床試験成績
眼表面疾患の
原因となる病気
予期せずに突然視力が失われてしまうと、その人の日常生活には支障をきたし、その後の人生設計も大きく変化することになります。
例えば、医薬品の副作用によって発症するスティーブンス・ジョンソン症候群(SJS)、自己免疫疾患である眼類天疱瘡、熱傷・化学薬品による事故やその他様々な病気で眼の表面(瞼や眼表面の粘膜など)に障害が起こることがあります。
これらの疾患などによって眼の表面に存在する幹細胞が障害された状態を、角膜上皮幹細胞疲弊症と呼びます。このような障害は年齢を問わず発症するおそれがあり、患者さまやご家族の皆さまにとっては、大きな不安にさらされることになります。
サクラシーは、角膜上皮幹細胞疲弊症により生じた眼表面の癒着に対する治療法として開発されました。
眼表面疾患の原因となりうる病気の例として、以下のようなものがあります。
-
原因傷病名症状
-
スティーブンス・ジョンソン症候群(SJS)/中毒性表皮壊死融解症(TEN)国の指定難病です。薬の服用や感染症などの後、高熱、皮膚や粘膜の発疹などが生じます。非常に重篤な自己免疫性の疾患で命にかかわります。
-
眼類天疱瘡(OCP)国の指定難病です。特に高齢者に多くみられます。免疫の不具合により自分の抗体が自分自身を攻撃してしまうことで、眼の粘膜にもびらんなどが生じます。
-
熱・化学外傷熱傷や化学薬品が目にかかってしまうなどの事故です。
-
移植片対宿主病(GVHD)白血病の治療で造血幹細胞移植(骨髄移植)をした患者さまに発症することがあります。骨髄ドナーの方の免疫細胞(リンパ球)が、移植を受けた患者さまの身体を攻撃してしまう免疫性疾患です。
-
再発翼状片翼状片は、結膜(白目)部分の異常増殖により、角膜(黒目)にくっついてしまった状態です。治療しても再発することがあります。
-
眼腫瘍瞼や結膜、涙腺などの眼表面にできる腫瘍があります。網膜や視神経など眼球の内部にできる腫瘍もあります。
これらのサイトもご参照ください。
開発の経緯
京都府立医科大学眼科学教室 木下茂先生らによって培養自家口腔粘膜上皮シートの研究が行われてきました。2002年より臨床研究が開始され、2008年までに72例への移植が実施されました。これらはレトロスペクティブな解析により、その効果が検証されました。
その後、厚生労働科学研究委託費の支援のもと先進医療B(2014年7月 - 2017年9月)が実施され、次いで眼表面の癒着解除を目的として京都府立医科大学眼科学教室の外園千恵先生により重症ステムセル疲弊症を対象にした医師主導治験「難治性眼表面疾患患者における粘膜上皮供給を目的とした培養自家口腔粘膜上皮シート移植の多施設共同単群第3相試験」(2018年10月 - 2019年9月)が神戸医療産業都市推進機構(FBRI)による製造支援のもと実施されました。
弊社は、医師主導治験の成績に基づいて、角膜上皮幹細胞疲弊症の重度の患者さまを対象として新しい治療の選択肢を提供できるよう、
製造販売承認申請を厚労省に提出し、2022年1月20日付でサクラシーの承認を取得し、同年9月1日に保険適用となりました。
サクラ(桜)は、当社ゆかりの地である青森県弘前市と開発の拠点である京都市に共通する象徴であり、患者さまの視力が改善し、再び桜が観えるように祈りを込めてサクラシーと命名されました。

木下茂 先生
- 京都府立医科大学名誉教授
- 2015年より京都府立医科大学特任講座感覚器未来医療学教授
- 日本角膜学会名誉会員
- 日本角膜移植学会理事(2023年度)
1992年に京都府立医科大学眼科学教室 第10代教授に就任され、「臨床の府立」をモットーに最高の診療を追求して患者に提供するという考えのもとに、難治性眼疾患に対するトランスレーショナル研究を目指してこられました。
特に角膜再生医学の研究を進められ、1999年には培養角膜上皮シート移植の臨床試験を、2001年にはサクラシーの基礎となる自家培養口腔粘膜上皮シート作成に成功し、このシート移植術により角膜再生医療への新たな糸口を見出されております。

外園千恵 先生
- 京都府立医科大学 眼科学教室 教授(2015年~)
- 日本眼科学会常務理事(2023年4月~)
- 日本角膜学会理事(2023年4月~2025年2月)
- 日本角膜学会理事長(2025年3月~)
教授就任以前から木下前教授と共に、難治性眼表面疾患に対する治療法の研究の中心として活躍されてきました。
培養自家口腔粘膜上皮細胞シート移植に関する臨床研究を進められている時期は、再生医療に関する法整備・制度設計の過渡期でもありましたが、サクラシーを患者さまのもとに届けるため、精力的に開発に取り組まれてこられました。
京都府立医科大学眼科学教室のサイトもご参照ください。
治療スキーム
口腔粘膜上皮細胞シートの製造と移植

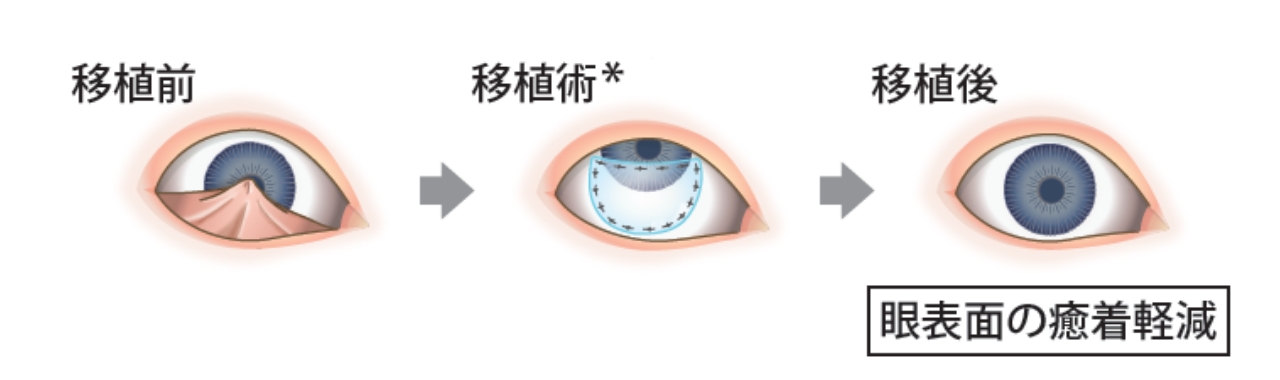
サクラシーは適切な形に裁断して角膜および角膜以外にも移植可能
-
患者さまより口腔粘膜組織を採取したします。(必要に応じて、事前の歯科治療など口腔環境を整えてください。採取当日には十分な消毒を実施ください)
-
採取した組織を製造所に輸送し、羊膜基質上にて培養いたします。(約2週間)
-
眼表面の癒着を解除し、サクラシーを移植します。(適宜、免疫抑制剤での術後管理をお願いします)
移植後の管理
必要に応じて以下を行ってください。
-
治療用コンタクトレンズの装用
-
原疾患が眼類天疱瘡以外の場合には、シクロスポリンとして1日量2~3mg/kgを術翌日から経口投与する。なお症状により適宜増減する。
-
原疾患が眼類天疱瘡の場合には、シクロスポリンとして1日量2~3mg/kgを術翌日から経口投与及びシクロホスファミド(無水物換算)として50mg を1日1回、術翌日から経口投与する。なお、症状により適宜増減する。
臨床成績
2018年10月~2019年9月、国内第3相医師主導治験(課題名「難治性眼表面疾患患者における粘膜上皮供給を目的とした培養自家口腔粘膜上皮シート移植の多施設共同単群第3相試験」)が実施されました。
-
目的重症のステムセル疲弊を伴う難治性眼表面疾患患者として、原疾患がスティーブンス・ジョンソン症候群、眼類天疱瘡、熱・化学外傷であり、かつ眼表面に高度癒着※を伴う者を対象とし、口腔粘膜上皮細胞シートの粘膜上皮供給としての有効性及び安全性を検討する。
-
対象患者数7例
-
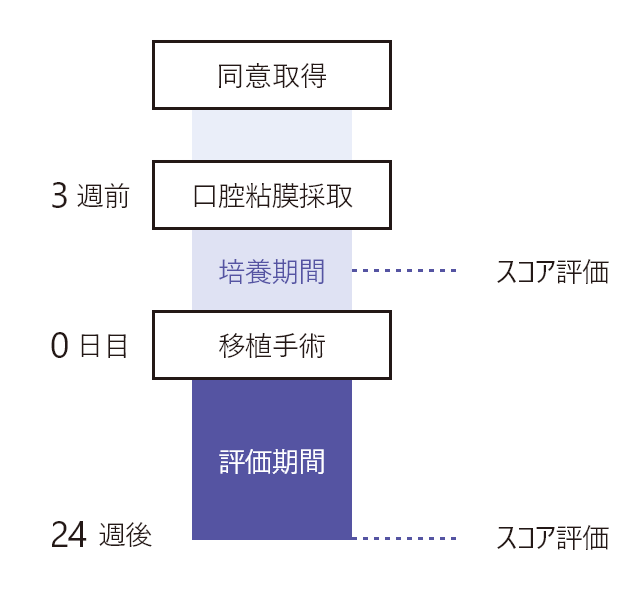
試験方法移植実施の3週間前に被験者の口腔粘膜組織を採取する。培養口腔粘膜上皮シートを作製、移植を実施後24週に評価を実施した。(移植後約2週間は入院により経過観察)
-
組入れ基準角膜上皮移植では予後不良、又は羊膜移植のみでは予後が期待できない難治性眼表面疾患を有する者。具体的にはスティーブンス・ジョンソン症候群、眼類天疱瘡、熱・化学外傷のいずれかに該当し、かつ眼表面に高度癒着(癒着スコア≧4)を伴う者。
癒着スコア
瞼球癒着及び結膜嚢癒着(上・下)のスコアの合計
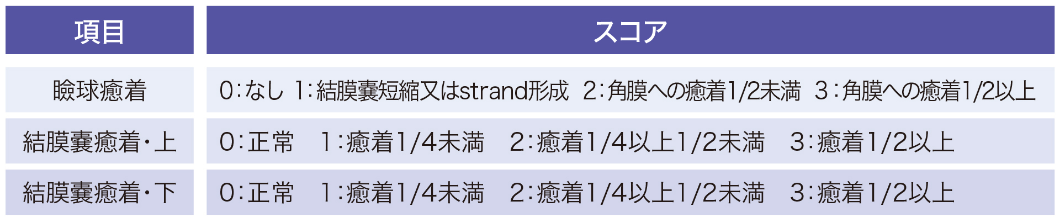
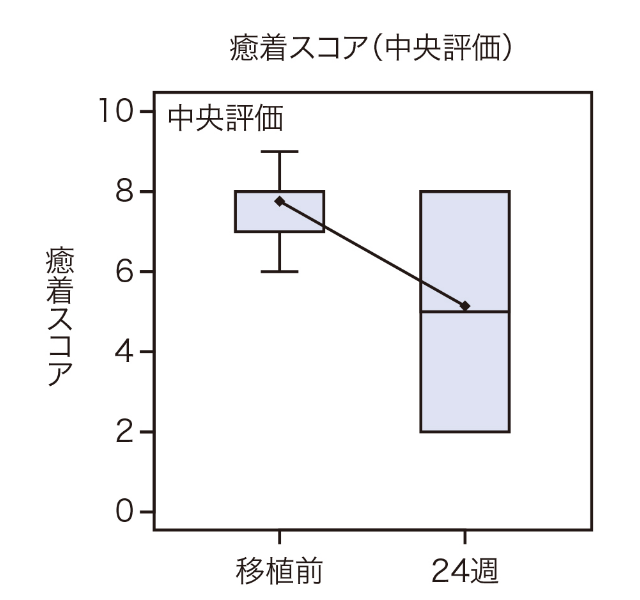
症例ごとの背景情報と癒着スコアの変化は下表の通りでした。
試験スケジュール
試験結果
移植後24週における移植前からの癒着スコアの変化量(中央評価)の平均値は、-2.6(95% CI:―4.5 ~ -0.7)であり、1標本t検定において統計学的有意差が認められました(p=0.017)。